Производител Добра цена Натриев бикарбонат CAS: 144-55-8
Приложения на натриев бикарбонат
1. Натриевият бикарбонат, използван под формата на сода бикарбонат и бакпулвер, е най-разпространеният набухвател. Когато содата бикарбонат, която е алкално вещество, се добави към смес, тя реагира с киселинна съставка, за да произведе въглероден диоксид. Реакцията може да бъде представена като: NaHCO3(s) + H+ → Na+(aq) + H2O(l) + CO2(g), където H+ се доставя от киселината. Бакпулверите съдържат сода бикарбонат като основна съставка, заедно с киселина и други съставки. В зависимост от формулата, бакпулверите могат да произвеждат въглероден диоксид бързо като прах с еднократно действие или на етапи, както при прах с двойно действие. Содата бикарбонат се използва и като източник на въглероден диоксид за газирани напитки и като буфер. В допълнение към печенето, содата бикарбонат има множество приложения в домакинството. Използва се като общо почистващо средство, дезодорант, антиацид, средство за потискане на огъня и в лични продукти като паста за зъби. Натриевият бикарбонат е слаба основа във воден разтвор с pH около 8. Бикарбонатният йон (HCO3-) има амфотерни свойства, което означава, че може да действа както като киселина, така и като основа. Това придава на содата бикарбонат буферен капацитет и способността да неутрализира както киселини, така и основи. Хранителните миризми, получени от киселинни или основни съединения, могат да бъдат неутрализирани със сода бикарбонат до соли без мирис. Тъй като натриевият бикарбонат е слаба основа, той има по-голяма способност да неутрализира киселинните миризми.
Втората по големина употреба на натриевия бикарбонат, представляваща приблизително 25% от общото производство, е като селскостопанска фуражна добавка. При говедата той помага за поддържане на pH в търбуха и подпомага смилаемостта на фибрите; при домашните птици той помага за поддържане на електролитния баланс, като осигурява натрий в диетата, помага на птиците да понасят топлина и подобрява качеството на черупките на яйцата.
Натриевият бикарбонат се използва в химическата промишленост като буфериращ агент, разпенващ агент, катализатор и химическа суровина. Натриевият бикарбонат се използва в кожарската промишленост за предварителна обработка и почистване на кожи и за контрол на pH по време на процеса на дъбене. Нагряването на натриевия бикарбонат произвежда натриев карбонат, който се използва за производство на сапун и стъкло. Натриевият бикарбонат се влага във фармацевтични продукти, за да служи като антиацид, буфериращ агент и във формулировки като източник на въглероден диоксид в ефервесцентни таблетки. Сухихимичните пожарогасители тип BC съдържат натриев бикарбонат (или калиев бикарбонат). Други приложения на бикарбоната включват преработка на целулоза и хартия, пречистване на вода и пробиване на нефтени кладенци.
2. Натриевият бикарбонат е набухвател с pH приблизително 8,5 в 1% разтвор при 25°C. Той взаимодейства с хранителни фосфати (кисели набухватели), за да освободи въглероден диоксид, който се разширява по време на процеса на печене, за да осигури на изпечените изделия увеличен обем и крехки хранителни качества. Използва се и в сухи смеси за напитки за получаване на карбонизация, която се получава, когато към сместа, съдържаща натриев бикарбонат и киселина, се добави вода. Той е компонент на бакпулвера. Нарича се още сода бикарбонат, сода бикарбонат, натриев киселинен карбонат и натриев хидрогенкарбонат.
3. Производство на много натриеви соли; източник на CO2; съставка на бакпулвер, ефервесцентни соли и напитки; в пожарогасители, почистващи препарати.
4. Натриевият бикарбонат (сода бикарбонат) е неорганична сол, използвана като буфериращ агент и регулатор на pH, служи и като неутрализатор. Използва се в пудри за изглаждане на кожата.
Спецификация на натриев бикарбонат
| Съединение | Спецификация |
| Общо съдържание на алкали (като NaHCO3) | 99,4% |
| Загуба при сушене | 0,07% |
| Хлорид (като CI) | 0,24% |
| Белота | 88.2 |
| pH (10 г/л) | 8.34 |
| Като мг/кг | 1 |
| Тежки метали мг/кг | 1 |
| Амониева сол | Пас |
| Яснота | Пас |
Опаковка на натриев бикарбонат
25 кг/торба
СъхранениеСъхранявайте в добре затворена, светлоустойчива и защитена от влага опаковка.


Нашите предимства

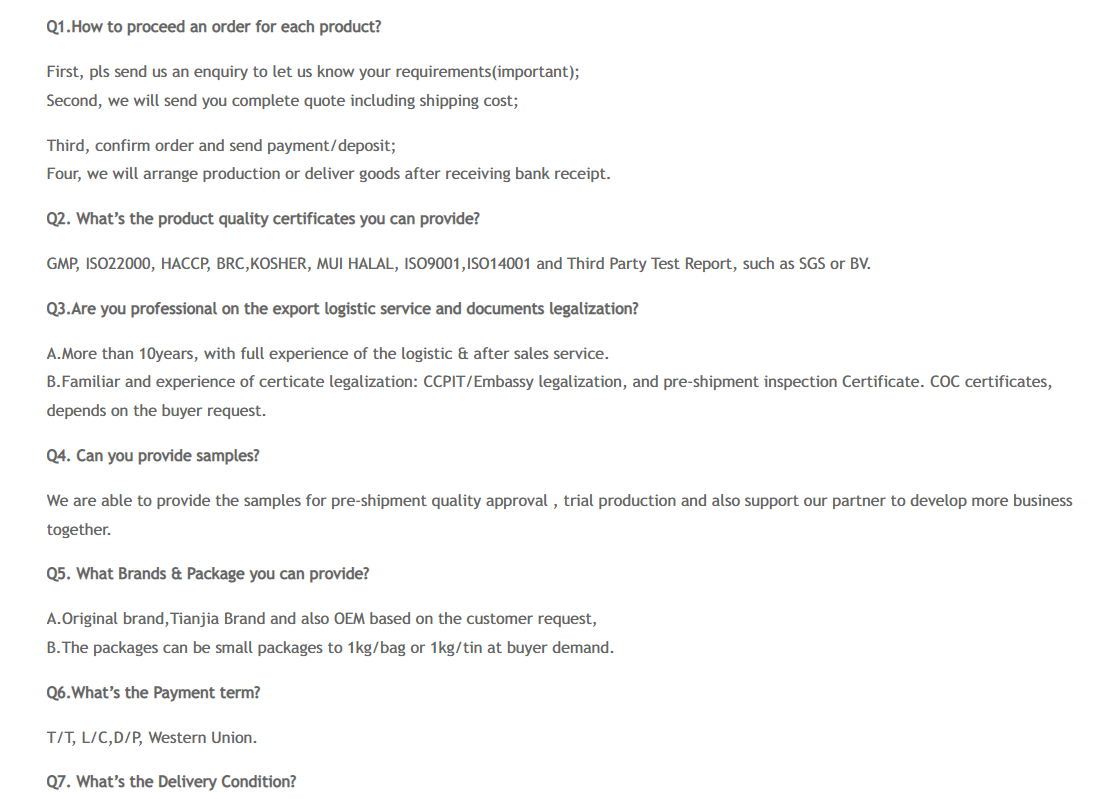
ЧЗВ